V experimentoch qPCR je veľmi dôležitým článkom aj návrh priméru.To, či sú primery vhodné alebo nie, úzko súvisí s tým, či účinnosť amplifikácie dosahuje štandard, či sú amplifikované produkty špecifické a či sú dostupné experimentálne výsledky.
Ako teda zlepšiť špecificitu priméru qPCR?Vysoká účinnosť zosilnenia?
Dnes vás zavedieme k spoločnému návrhu primérov qPCR a umožníme, aby sa návrh primérov qPCR stal účinnou tradíciou v experimentoch.
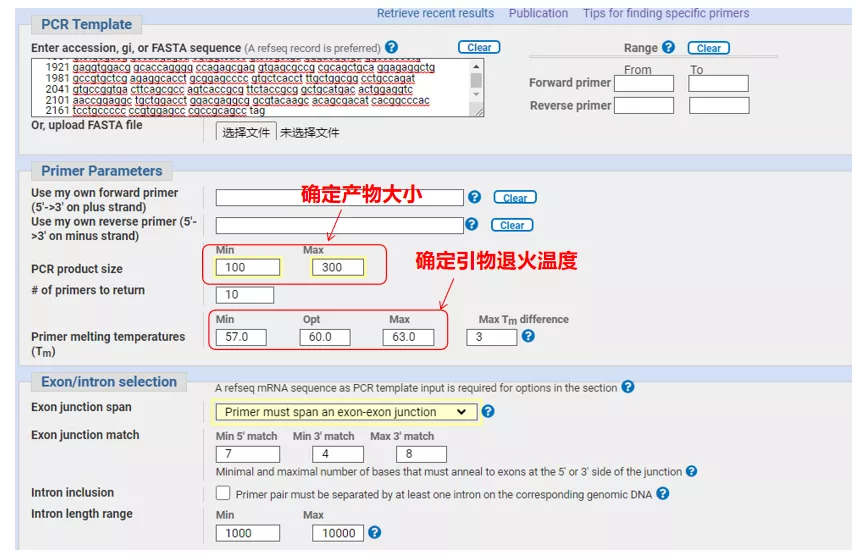
Pri navrhovaní primérov qPCR zvyčajne venujte pozornosť nasledujúcim bodom: priméry by mali byť navrhnuté čo najviac naprieč intrónmi, dĺžka produktu by mala byť 100 – 300 bp, hodnota Tm by mala byť čo najbližšie k 60 °C a priméry upstream a downstream by mali byť čo najbližšie a koniec priméru by mal byť G alebo C atď.
1. Návrh primérov preklenujúcich intróny
Pri navrhovaní primérov qPCR môže výber primérov navrhnutých pre intróny zabrániť amplifikácii templátu gDNA a všetky produkty sú odvodené z amplifikácie cDNA, čím sa eliminuje vplyv kontaminácie gDNA.
2. Dĺžka základného náteru
Dĺžka priméru je všeobecne medzi 18-30 nt a dĺžka amplifikačného produktu by mala byť čo najviac kontrolovaná medzi 100-300 bp.
Ak je primer príliš krátky, povedie to k nešpecifickej amplifikácii, a ak je príliš dlhý, ľahko vytvorí sekundárnu štruktúru (napríklad vlásenkovú štruktúru).Ak je produkt amplifikácie príliš dlhý, nie je vhodný na reakciu polymerázy, čo ovplyvní účinnosť PCR amplifikácie.
3. Obsah GC a hodnota Tm
Obsah GC v primeroch by mal byť kontrolovaný medzi 40 % a 60 %.Ak je príliš vysoká alebo príliš nízka, nie je vhodná na spustenie reakcie.Obsah GC priamych a reverzných primérov by mal byť takmer rovnaký, aby sa získala rovnaká hodnota Tm a teplota žíhania.
Hodnota Tm by mala byť medzi 55-65 °C, pokiaľ je to možné, vo všeobecnosti okolo 60 °C, a hodnota Tm proti prúdu a po prúde by mala byť čo najbližšie, výhodne nie viac ako 4 °C.
4. Vyhnite sa výberu A na 3′ konci základného náteru
Keď sa 3' koniec priméru nezhoduje, existujú veľké rozdiely v účinnosti syntézy rôznych báz.Keď je poslednou bázou A, môže tiež iniciovať syntézu reťazca dokonca aj v prípade nesprávneho párovania, a keď je poslednou bázou T When, účinnosť indukcie nesúladu je značne znížená.Preto sa snažte vyhnúť výberu A na 3′ konci základného náteru a je lepšie zvoliť T.
Ak ide o primér sondy, 5′ koniec sondy nemôže byť G, pretože aj keď je jedna G báza pripojená k fluorescenčnej reportérovej skupine FAM, G môže tiež utlmiť fluorescenčný signál emitovaný skupinou FAM, čo vedie k falošne negatívnym výsledkom.Objavte sa.
5. Základné rozdelenie
Distribúcia štyroch báz v primeru je výhodne náhodná, vyhýbajúc sa viac ako 3 po sebe idúcim G alebo C na 3' konci a viac ako 3 po sebe idúcimG alebo C je ľahké vytvoriť párovanie v oblasti sekvencie bohatej na GC.
6. Oblasť návrhu základného náteru by sa mala vyhnúť zložitým sekundárnym štruktúram.
Sekundárna štruktúra tvorená jedným vláknom amplifikačného produktu ovplyvní hladký priebeh PCR.Predpovedaním, či je v cieľovej sekvencii sekundárna štruktúra vopred, sa snažte vyhnúť tejto oblasti pri navrhovaní primérov.
7. Priméry samotné a medzi primérmi by sa mali snažiť vyhnúť po sebe idúcim komplementárnym bázam.
Medzi primérom samotným a primérom nemôže existovať žiadna následná komplementarita 4 báz.Samotný primér by nemal mať komplementárnu sekvenciu, inak sa sám zloží a vytvorí vlásenkovú štruktúru, ktorá ovplyvní kombináciu priméru a templátu.
Komplementárne sekvencie nemôžu existovať medzi upstream a downstream primérmi.Komplementarita medzi primérmi vytvorí primérové diméry, ktoré znížia účinnosť PCR a dokonca ovplyvnia kvantitatívnu presnosť.Ak sú štruktúry primer-dimér a vlásenky nevyhnutné, hodnota △G by nemala byť príliš vysoká (mala by byť nižšia ako 4,5 kcal/mol).
8. Priméry amplifikujú cieľový špecifický produkt.
Konečným cieľom detekcie qPCR je pochopiť množstvo cieľového génu.Ak dôjde k nešpecifickej amplifikácii, kvantifikácia bude nepresná.Preto, keď sú priméry navrhnuté, musia byť testované pomocou BLAST a špecifickosť produktov je porovnaná v sekvenčnej databáze.
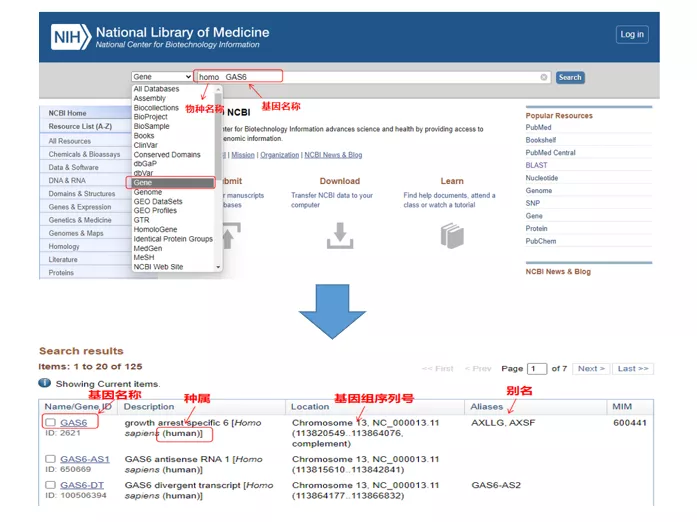
Ďalej berieme ľudský gén GAS6 (špecifický 6 na zastavenie rastu) ako príklad na navrhnutie primérov qPCR.
01 dotazovací gén
Homo GAS6prostredníctvom NCBI.Tu by sme mali venovať pozornosť porovnávaniu názvu génu a druhu, aby sme sa uistili, že sú konzistentné.
 02 Nájdite sekvenciu génov
02 Nájdite sekvenciu génov
(1) Ak je cieľovou sekvenciou genómová DNA, vyberte prvú, ktorou je sekvencia genómovej DNA génu.
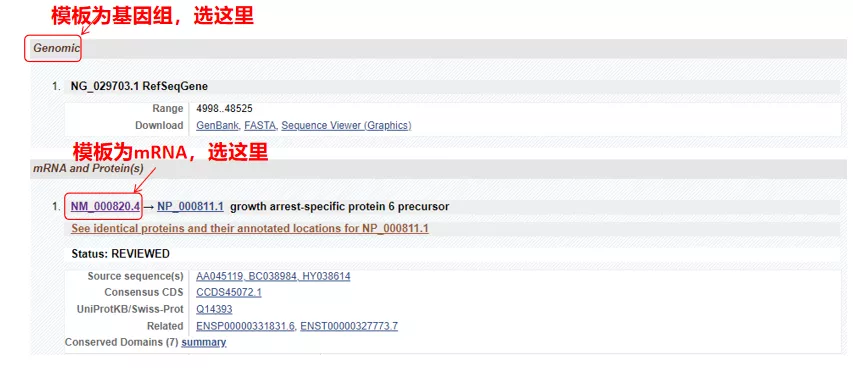 (2) Ak je cieľovou sekvenciou mRNA, vyberte druhú.Po zadaní kliknite na „CDS“ v tabuľke nižšie.Sekvencia hnedého pozadia je kódujúca sekvencia génu.
(2) Ak je cieľovou sekvenciou mRNA, vyberte druhú.Po zadaní kliknite na „CDS“ v tabuľke nižšie.Sekvencia hnedého pozadia je kódujúca sekvencia génu.
 03 Dizajnové základné nátery
03 Dizajnové základné nátery
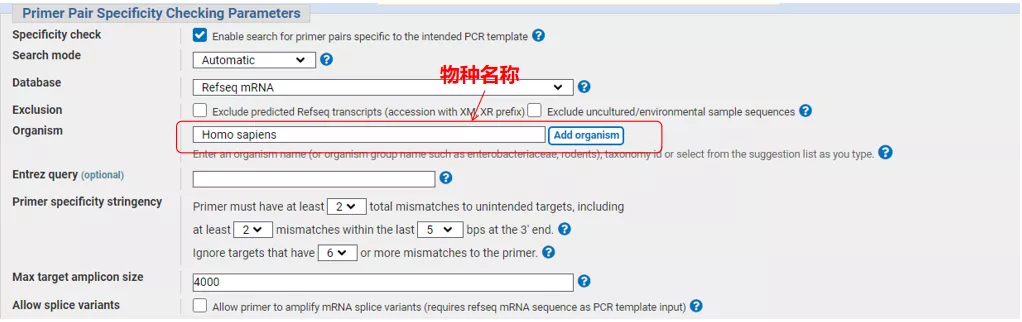
Vstúpte do rozhrania Primer-BLAST
 Zadajte sekvenčné číslo génu alebo sekvenciu vo formáte Fasta vľavo hore a vyplňte príslušné parametre.
Zadajte sekvenčné číslo génu alebo sekvenciu vo formáte Fasta vľavo hore a vyplňte príslušné parametre.
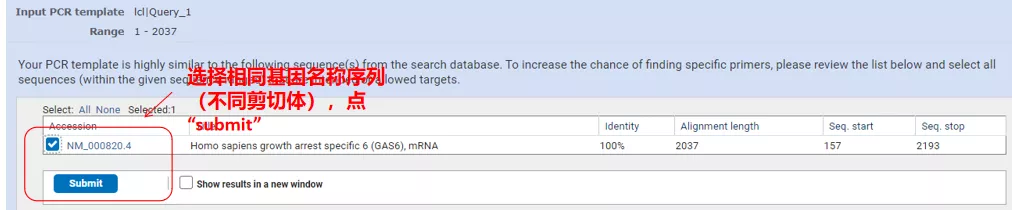
Kliknite na „Get primers“ (Získať primery) a objaví sa NCBI, ktorá vám oznámi, že takýto výber parametrov bude zosilnený na iné varianty spájania.Môžeme skontrolovať rôzne varianty zostrihu a predložiť ich, aby sme získali vhodný pár primérov (ako je znázornené na obrázku nižšie).Tento proces môže trvať desiatky sekúnd.
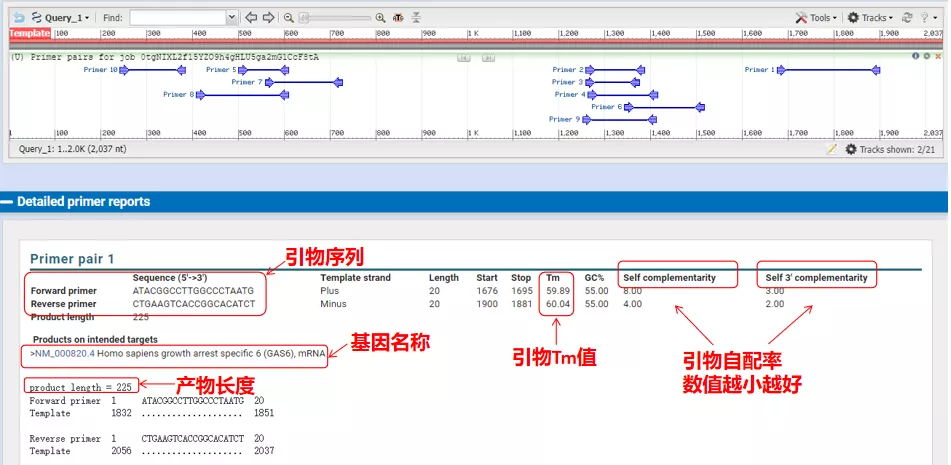 Teploty žíhania týchto párov primérov sú okolo 60 °C.Podľa účelu experimentu vyberte primery so strednou dĺžkou, dobrou špecifickosťou a menšou samokomplementáciou primerov pre experiment a miera úspešnosti je pomerne vysoká!
Teploty žíhania týchto párov primérov sú okolo 60 °C.Podľa účelu experimentu vyberte primery so strednou dĺžkou, dobrou špecifickosťou a menšou samokomplementáciou primerov pre experiment a miera úspešnosti je pomerne vysoká!
04Overenie špecifickosti priméru
V skutočnosti môže Primer-Blast okrem navrhovania primerov vyhodnotiť aj primery, ktoré sme sami navrhli.Vráťte sa na stránku návrhu primeru, zadajte upstream a downstream primery, ktoré sme navrhli, a ostatné parametre nebudú upravené.Po odoslaní môžete vidieť, či pár primérov existuje aj na iných génoch.Ak sú všetky zobrazené na géne, ktorý chceme amplifikovať, čo naznačuje, že špecifickosť tohto páru primérov je skvelá!(Napríklad toto je jediný výsledok dopytu priméra!)
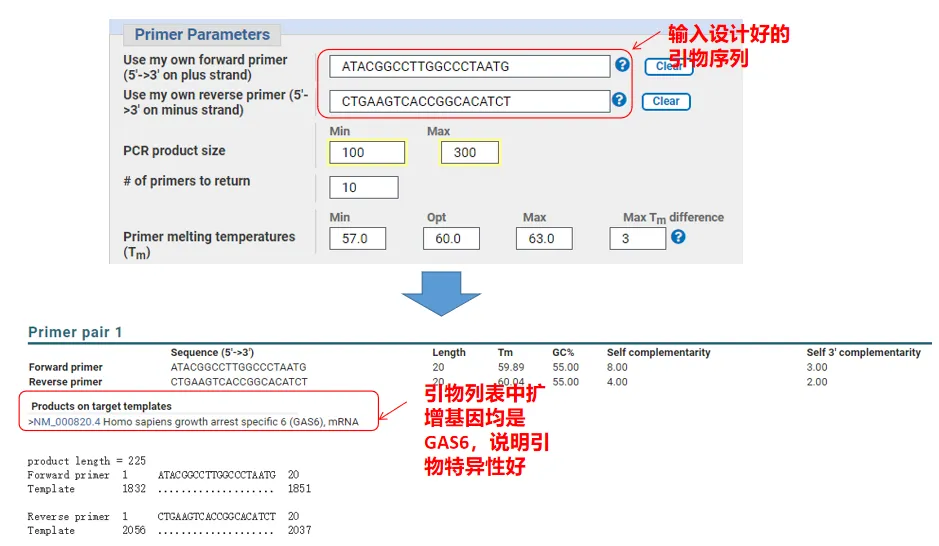
05 Posudok kvality základného náteru
Aký druh priméru je „dokonalý“ primér, ktorý kombinuje „účinnosť amplifikácie až po štandard“, „amplifikované charakteristiky produktu“ a „spoľahlivé experimentálne výsledky“?
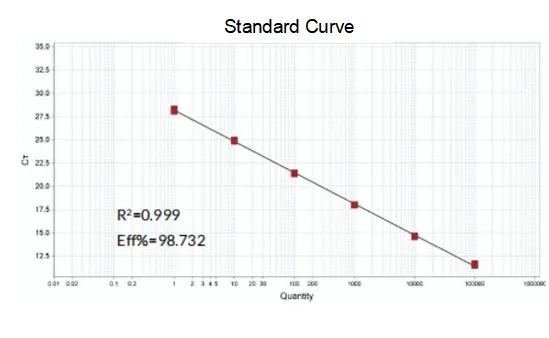 Účinnosť zosilnenia
Účinnosť zosilnenia
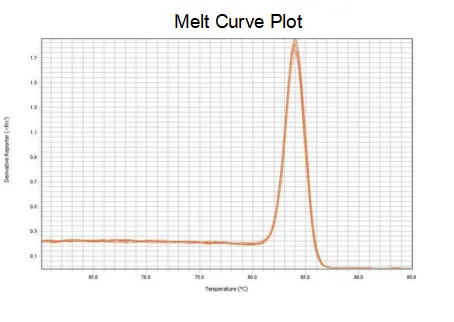 krivka topenia
krivka topenia
Účinnosť amplifikácie primerov dosahuje 90 % až 110 %, čo znamená, že účinnosť amplifikácie je dobrá a krivka topenia má jeden vrchol a zvyčajne Tm > 80 °C, čo znamená, že špecificita amplifikácie je dobrá.
Súvisiace produkty:
Real Time PCR Easy – SYBR GREEN I
Real Time PCR Easy-Taqman
Čas odoslania: Feb-10-2023








