PCR (polymerázová reťazová reakcia) je jednou z technológií amplifikácie DNA in vitro s viac ako 30-ročnou históriou.
Technológia PCR bola priekopníkom Kary Mullis z Cetus, USA v roku 1983. Mullis požiadal o patent na PCR v roku 1985 av tom istom roku publikoval prvý akademický článok PCR o vede.Mullis za svoju prácu získal v roku 1993 Nobelovu cenu za chémiu.
Základné princípy PCR
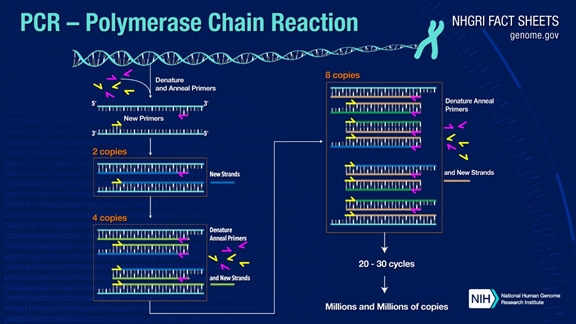
PCR môže amplifikovať cieľové fragmenty DNA viac ako miliónkrát.Princíp je pod katalýzou DNA polymerázy s použitím materského vlákna DNA ako templátu a špecifického priméru ako východiskového bodu pre predlžovanie.Replikuje sa in vitro prostredníctvom krokov, ako je denaturácia, žíhanie a predlžovanie.Proces dcérskeho vlákna DNA komplementárneho k templátovej DNA rodičovského vlákna.
Štandardný proces PCR je rozdelený do troch krokov:
1. Denaturácia: Na oddelenie dvojitých reťazcov DNA použite vysokú teplotu.Vodíková väzba medzi dvojitými vláknami DNA sa preruší pri vysokej teplote (93-98 °C).
2.Žíhanie: Po oddelení dvojvláknovej DNA znížte teplotu, aby sa primér mohol naviazať na jednovláknovú DNA.
3. Predĺženie: DNA polymeráza začne syntetizovať komplementárne vlákna pozdĺž reťazcov DNA z primérov naviazaných, keď sa teplota zníži.Po dokončení predlžovania sa dokončí cyklus a počet fragmentov DNA sa zdvojnásobí
Vrátením týchto troch krokov 25-35-krát sa počet fragmentov DNA exponenciálne zvýši.
Vynaliezavosť PCR spočíva v tom, že rôzne priméry môžu byť navrhnuté pre rôzne cieľové gény, takže fragmenty cieľových génov môžu byť amplifikované v krátkom časovom období.
Zatiaľ možno PCR rozdeliť do troch kategórií, a to obyčajná PCR, fluorescenčná kvantitatívna PCR a digitálna PCR.
Prvá generácia bežnej PCR
Na amplifikáciu cieľového génu použite bežný prístroj na amplifikáciu PCR a potom použite elektroforézu na agarózovom géli na detekciu produktu, možno vykonať iba kvalitatívnu analýzu.
Hlavné nevýhody prvej generácie PCR:
1. Sklon k nešpecifickej amplifikácii a falošne pozitívnym výsledkom.
2. Detekcia trvá dlho a operácia je ťažkopádna.
3. Je možné vykonať iba kvalitatívny test
Real-Time PCR druhej generácie
Real-Time PCR, tiež známa ako qPCR, používa fluorescenčné sondy, ktoré môžu indikovať postup reakčného systému a monitoruje akumuláciu amplifikovaných produktov prostredníctvom akumulácie fluorescenčných signálov a posudzuje výsledky prostredníctvom fluorescenčnej krivky.Môže sa kvantifikovať pomocou hodnoty Cq a štandardnej krivky.
Pretože technológia qPCR prebieha v uzavretom systéme, znižuje sa pravdepodobnosť kontaminácie a fluorescenčný signál je možné monitorovať pre kvantitatívnu detekciu, takže je v klinickej praxi najpoužívanejšou a stala sa dominantnou technológiou v PCR.
Fluorescenčné látky používané pri fluorescenčnej kvantitatívnej PCR v reálnom čase možno rozdeliť na: fluorescenčnú sondu TaqMan, molekulárne majáky a fluorescenčné farbivo.
1) Fluorescenčná sonda TaqMan:
Počas PCR amplifikácie sa pridáva špecifická fluorescenčná sonda, pričom sa pridáva pár primerov.Sonda je oligonukleotid a oba konce sú označené reportérovou fluorescenčnou skupinou a zhášacou fluorescenčnou skupinou.
Keď je sonda neporušená, fluorescenčný signál emitovaný reportérovou skupinou je absorbovaný zhášacou skupinou;počas amplifikácie PCR 5′-3′ exonukleázová aktivita enzýmu Taq štiepi a degraduje sondu, čím sa reportérová fluorescenčná skupina a zhášač oddelí Fluorescenčná skupina je oddelená, takže fluorescenčný monitorovací systém môže prijímať fluorescenčný signál, to znamená vždy, keď sa zosilní reťazec DNA, vytvorí sa synchronizovaná molekula fluorescencie, vytvorí sa fluorescenčný signál a úplne sa vytvorí fluorescenčný signál PCR
2) Fluorescenčné farbivo SYBR:
V reakčnom systéme PCR sa pridá nadbytok fluorescenčného farbiva SYBR.Po nešpecifickom začlenení fluorescenčného farbiva SYBR do dvojvlákna DNA vyšle fluorescenčný signál.Molekula farbiva SYBR, ktorá nie je začlenená do reťazca, nebude emitovať žiadny fluorescenčný signál, čím sa zabezpečí fluorescenčný signál. Nárast produktov PCR je úplne synchronizovaný s nárastom produktov PCR.SYBR sa viaže iba na dvojvláknovú DNA, takže krivka topenia sa môže použiť na určenie, či je reakcia PCR špecifická.
3) Molekulárny maják:
Je to oligonukleotidová sonda s dvojitou slučkou, ktorá tvorí vlásenkovú štruktúru s približne 8 bázami na 5 a 3 koncoch.Sekvencie nukleových kyselín na oboch koncoch sú komplementárne spárované, čo spôsobuje, že fluorescenčná skupina a zhášacia skupina sú tesné.Zatvorte, nebude produkovať fluorescenciu.
Po vytvorení produktu PCR sa počas procesu žíhania stredná časť molekulárneho majáku spáruje so špecifickou sekvenciou DNA a fluorescenčný gén sa oddelí od zhášacieho génu, aby sa vytvorila fluorescencia.
Hlavné nevýhody PCR druhej generácie:
Stále chýba citlivosť a detekcia vzoriek s malým počtom kópií je nepresná.
Existuje vplyv hodnoty pozadia a výsledok je náchylný na rušenie.
Ak sú v reakčnom systéme inhibítory PCR, výsledky detekcie sú náchylné na interferenciu.
Digitálna PCR tretej generácie
Digitálna PCR (DigitalPCR, dPCR, Dig-PCR) vypočítava počet kópií cieľovej sekvencie prostredníctvom detekcie koncového bodu a môže vykonávať presnú absolútnu kvantitatívnu detekciu bez použitia interných kontrol a štandardných kriviek.
Digitálna PCR využíva detekciu koncového bodu a nezávisí od hodnoty Ct (prah cyklu), takže digitálna PCR reakcia je menej ovplyvnená účinnosťou amplifikácie a zlepšuje sa tolerancia voči inhibítorom PCR reakcie s vysokou presnosťou a reprodukovateľnosťou.
Vďaka vlastnostiam vysokej citlivosti a vysokej presnosti nie je ľahko rušený inhibítormi reakcie PCR a môže dosiahnuť skutočnú absolútnu kvantifikáciu bez štandardných produktov, čo sa stalo výskumným a aplikačným hotspotom.
Podľa rôznych foriem reakčnej jednotky ju možno rozdeliť do troch hlavných typov: mikrofluidné, čipové a kvapôčkové systémy.
1) Mikrofluidná digitálna PCR, mdPCR:
Na základe mikrofluidnej technológie je templát DNA oddelený.Mikrofluidná technológia môže realizovať nanoupgradáciu vzorky alebo generovanie menších kvapôčok, ale kvapôčky potrebujú špeciálnu adsorpčnú metódu a potom sa kombinujú s reakčným systémom PCR.mdPCR sa postupne preberala inými metódami.
2) Digitálna PCR založená na kvapkách, ddPCR:
Použite technológiu tvorby kvapiek voda v oleji na spracovanie vzorky na kvapky a rozdeľte reakčný systém obsahujúci molekuly nukleovej kyseliny na tisíce kvapiek nanometrov, z ktorých každá neobsahuje cieľovú molekulu nukleovej kyseliny, ktorá sa má detegovať, alebo obsahuje jednu až niekoľko cieľových molekúl nukleovej kyseliny, ktoré sa majú testovať.
3) Digitálna PCR na čipe, cdPCR:
Využite technológiu integrovanej dráhy tekutiny na vyrytie mnohých mikroskúmaviek a mikrodutín na kremíkové doštičky alebo kremenné sklo a regulujte prietok roztoku cez rôzne riadiace ventily a rozdeľte vzorku kvapaliny na nanometre rovnakej veľkosti do reakčných jamiek pre digitálnu PCR reakciu, aby ste dosiahli absolútnu kvantifikáciu.
Hlavné nevýhody tretej generácie PCR:
Zariadenie a činidlá sú drahé.
Požiadavky na kvalitu šablóny sú vysoké.Ak množstvo šablóny presiahne množstvo mikrosystému, nebude možné ho kvantifikovať a ak je príliš malé, presnosť kvantifikácie sa zníži.
Falošne pozitívne výsledky sa môžu generovať aj vtedy, keď dôjde k nešpecifickej amplifikácii.
Čas odoslania: 30. júla 2021