Technológia molekulárnej diagnostiky využíva metódy molekulárnej biológie na detekciu expresie a štruktúry genetického materiálu ľudského tela a rôznych patogénov, aby sa dosiahol účel predpovedania a diagnostiky chorôb.
V posledných rokoch, s modernizáciou a iteráciou technológie molekulárnej diagnostiky, sa klinická aplikácia molekulárnej diagnostiky stala čoraz rozsiahlejšou a hlbšou a trh molekulárnej diagnostiky vstúpil do obdobia rýchleho rozvoja.
Autor sumarizuje bežné molekulárne diagnostické technológie na trhu a je rozdelený do troch častí: prvá časť predstavuje technológiu PCR, druhá časť predstavuje technológiu izotermickej amplifikácie nukleových kyselín a druhá časť predstavuje technológiu sekvenovania.
01
Časť I: Technológia PCR
PCR technológia
PCR (polymerázová reťazová reakcia) je jednou z in vitro technológií amplifikácie DNA s viac ako 30-ročnou históriou.
Technológia PCR bola priekopníkom v roku 1983 Kary Mullis z Cetus, USA.Mullis požiadal o patent PCR v roku 1985 a v tom istom roku publikoval prvú akademickú prácu PCR o vede.Mullis získal Nobelovu cenu za chémiu v roku 1993.
Základné princípy PCR
PCR môže amplifikovať cieľové fragmenty DNA viac ako miliónkrát.Princíp spočíva v tom, že za katalýzy DNA polymerázy sa materské vlákno DNA používa ako templát a ako východiskový bod pre predlžovanie sa používa špecifický primér.Replikuje sa in vitro prostredníctvom krokov, ako je denaturácia, žíhanie a predlžovanie.Proces dcérskeho vlákna DNA komplementárneho k templátovej DNA rodičovského vlákna.
Štandardný proces PCR je rozdelený do troch krokov:
1. Denaturácia: Na oddelenie dvojitých reťazcov DNA použite vysokú teplotu.Vodíkové väzby medzi dvojvláknami DNA sa lámu pri vysokých teplotách (93-98°C).
2. Žíhanie: Po oddelení dvojvláknovej DNA sa teplota zníži, aby sa primér mohol naviazať na jednovláknovú DNA.
3. Predĺženie: DNA polymeráza začne syntetizovať komplementárne vlákna pozdĺž reťazcov DNA z primérov naviazaných, keď sa teplota zníži.Po dokončení predlžovania sa dokončí cyklus a počet fragmentov DNA sa zdvojnásobí.
Vrátením týchto troch krokov 25-35-krát sa počet fragmentov DNA exponenciálne zvýši.
Dômyselnosť PCR spočíva v tom, že rôzne priméry môžu byť navrhnuté pre rôzne cieľové gény, takže fragmenty cieľových génov môžu byť amplifikované v krátkom časovom období.
Zatiaľ možno PCR rozdeliť do troch kategórií, a to obyčajná PCR, fluorescenčná kvantitatívna PCR a digitálna PCR.
Prvá generácia bežnej PCR
Na amplifikáciu cieľového génu použite bežný prístroj na amplifikáciu PCR a potom použite elektroforézu na agarózovom géli na detekciu produktu, možno vykonať iba kvalitatívnu analýzu.
Hlavné nevýhody prvej generácie PCR:
-Sklon k nešpecifickej amplifikácii a falošne pozitívnym výsledkom.
-Detekcia trvá dlho a operácia je ťažkopádna.
-Je možné vykonať iba kvalitatívne testovanie.
Fluorescenčná kvantitatívna PCR druhej generácie
Fluorescenčná kvantitatívna PCR (Real-Time PCR), tiež známa ako qPCR, sa používa na monitorovanie akumulácie amplifikovaných produktov prostredníctvom akumulácie fluorescenčných signálov pridaním fluorescenčných sond, ktoré môžu indikovať postup reakčného systému, a na posúdenie výsledkov pomocou fluorescenčnej krivky a možno ju kvantifikovať pomocou hodnoty Cq a štandardnej krivky.
Pretože technológia qPCR prebieha v uzavretom systéme, znižuje sa pravdepodobnosť kontaminácie a fluorescenčný signál je možné monitorovať pre kvantitatívnu detekciu, takže je v klinickej praxi najpoužívanejšou a stala sa dominantnou technológiou v PCR.
Fluorescenčné látky používané pri fluorescenčnej kvantitatívnej PCR v reálnom čase možno rozdeliť na: fluorescenčné sondy TaqMan, molekulárne majáky a fluorescenčné farbivá.
1) Fluorescenčná sonda TaqMan:
Počas amplifikácie PCR sa pridáva špecifická fluorescenčná sonda, pričom sa pridáva pár primérov.Sonda je oligonukleotid a dva konce sú označené reportérovou fluorescenčnou skupinou a zhášacou fluorescenčnou skupinou.
Keď je sonda neporušená, fluorescenčný signál emitovaný reportérovou skupinou je absorbovaný zhášacou skupinou;počas amplifikácie PCR 5′-3′ exonukleázová aktivita enzýmu Taq štiepi a degraduje sondu, čím sa reportérová fluorescenčná skupina a zhášač oddelí Fluorescenčná skupina je oddelená, takže fluorescenčný monitorovací systém môže prijímať fluorescenčný signál, to znamená vždy, keď sa zosilní reťazec DNA, vytvorí sa synchronizovaná molekula fluorescencie, vytvorí sa fluorescenčný signál a úplne sa vytvorí fluorescenčný signál PCR
2) Fluorescenčné farbivá SYBR:
V reakčnom systéme PCR sa pridá nadbytok fluorescenčného farbiva SYBR.Po nešpecifickom začlenení fluorescenčného farbiva SYBR do dvojvlákna DNA vyšle fluorescenčný signál.Molekula farbiva SYBR, ktorá nie je začlenená do reťazca, nebude emitovať žiadny fluorescenčný signál, čím sa zabezpečí fluorescenčný signál. Nárast produktov PCR je úplne synchronizovaný s nárastom produktov PCR.SYBR sa viaže iba na dvojvláknovú DNA, takže krivka topenia sa môže použiť na určenie, či je reakcia PCR špecifická.
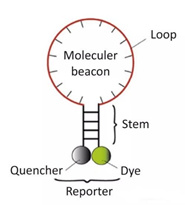
3) Molekulárne majáky
Je to oligonukleotidová sonda s dvojitou slučkou, ktorá tvorí vlásenkovú štruktúru s približne 8 bázami na 5 a 3 koncoch.Sekvencie nukleových kyselín na oboch koncoch sú komplementárne spárované, čo spôsobuje, že fluorescenčná skupina a zhášacia skupina sú tesné.Zatvorte, nebude produkovať fluorescenciu.
Po vytvorení produktu PCR sa počas procesu žíhania stredná časť molekulárneho majáku spáruje so špecifickou sekvenciou DNA a fluorescenčný gén sa oddelí od zhášacieho génu, aby sa vytvorila fluorescencia.
Hlavné nevýhody PCR druhej generácie:
Stále chýba citlivosť a detekcia vzoriek s malým počtom kópií nie je presná.
Existuje vplyv hodnoty pozadia a výsledok je náchylný na rušenie.
Digitálna PCR tretej generácie
Digitálna PCR (DigitalPCR, dPCR, Dig-PCR) vypočítava počet kópií cieľovej sekvencie prostredníctvom detekcie koncového bodu a môže vykonávať presnú absolútnu kvantitatívnu detekciu bez použitia interných kontrol a štandardných kriviek.
Digitálna PCR využíva detekciu koncového bodu a nezávisí od hodnoty Ct (prah cyklu), takže digitálna PCR reakcia je menej ovplyvnená účinnosťou amplifikácie a zlepšuje sa tolerancia voči inhibítorom PCR reakcie s vysokou presnosťou a reprodukovateľnosťou.
Vďaka vlastnostiam vysokej citlivosti a vysokej presnosti nie je ľahko rušený inhibítormi reakcie PCR a môže dosiahnuť skutočnú absolútnu kvantifikáciu bez štandardných produktov, čo sa stalo výskumným a aplikačným hotspotom.
Podľa rôznych foriem reakčnej jednotky ju možno rozdeliť do troch typov: mikrofluidné, čipové a kvapôčkové systémy.
Čas odoslania: júl-08-2021